基于寡肽的仿生水下胶黏剂在基础研究(如阐明天然粘附机制)和临床应用(如伤口愈合、止血、硬脑膜密封、心脏堵漏等手术胶水)方面展现出巨大潜力,近年来备受关注。寡肽作为天然蛋白质的简化模型,具有良好的生物相容性、可降解性、设计灵活性及可规模化合成等优势。然而,其长度有限导致缠结能力差、体相内聚力低,这一固有缺陷限制了其界面粘附性能。为此,研究者尝试利用多金属氧簇、单宁酸、纳米颗粒、碳点等分子交联剂与寡肽通过物理浓缩制备水下胶黏剂。然而,目前成功的例子仅限于电荷可控但生物毒性极大的多金属氧簇。其它的分子交联剂由于结合位点众多,难以精确控制等局限均未能获得成功。这些问题极大限制了寡肽水下胶黏剂的生物应用。
针对上述问题,李文教授团队报道了一种构筑寡肽水下胶黏剂的新范式,即利用水相分散的自组装胶体粒子作为超分子交联剂,通过非共价相互作用介导阳离子寡肽物理缩合,成功制备了一系列寡肽水下胶黏剂。这种胶体型超分子交联剂的设计理念打破了传统分子交联剂对尺寸、交联位点数目和拓扑结构的严格要求,为构建寡肽医用胶黏剂提供了通用的合成策略。作者以性胆甾酸衍生物(CADs)为例,这类两亲性小分子具有疏水的刚性甾体和亲水的羧酸盐,可在水中自组装形成表面富含羧酸根的纳米纤维胶体。这些带负电的纤维胶体作为多价超分子交联剂与阳离子寡肽通过静电、氢键、疏水效应等多重非共价相互作用,缩合形成具有三维网络结构的水下胶黏剂。ITC分析表明,交联过程以焓驱动为主,熵效应为辅。详细研究发现寡肽序列中精氨酸残基胍盐的独特理化性质(如芳香性、平面性、双齿或多齿氢键效应)在材料设计中是不可或缺的重要组成部分,其通过离子键、双齿氢键、疏水作用和π- π堆积作用等对界面黏附和内聚力具有协同贡献。所得寡肽胶黏剂能在水下展现出广谱、可靠的粘接行为。例如常见的固体基底聚醚醚酮、玻璃、聚四氟乙烯、聚丙烯、钛、不锈钢)及生物组织(鸡心、猪肝、猪皮、牛骨)。其水下粘接强度在11.6~ 186.7 kPa的范围内。此外,作者还展示了寡肽序列和超分子交联剂类型对胶黏剂最终粘接性能的调控规律,以及材料的生物相容性。这项研究验证了胶体型超分子交联剂在构建肽基水下胶粘剂方面的有效性,阐明了性能优化的关键结构-功能关系,不仅为肽基仿生水下胶黏剂的构建提供了通用策略,也为肽基水下胶黏剂在生物医学领域的应用奠定了物质基础。
上述成果以“Colloidal Supramolecular Cross-Linkers: A Versatile Platform for Physical Condensation of Oligopeptide Segments into All Underwater Adhesives”为题发表在Nano Letters(DOI: 10.1021/acs.nanolett.5c02173)。91视频-性视频-国产视频
博士研究生王馨妍为第一作者,李文教授为通讯作者。该研究得到国家自然科学基金和吉林省自然科学基金的资助。
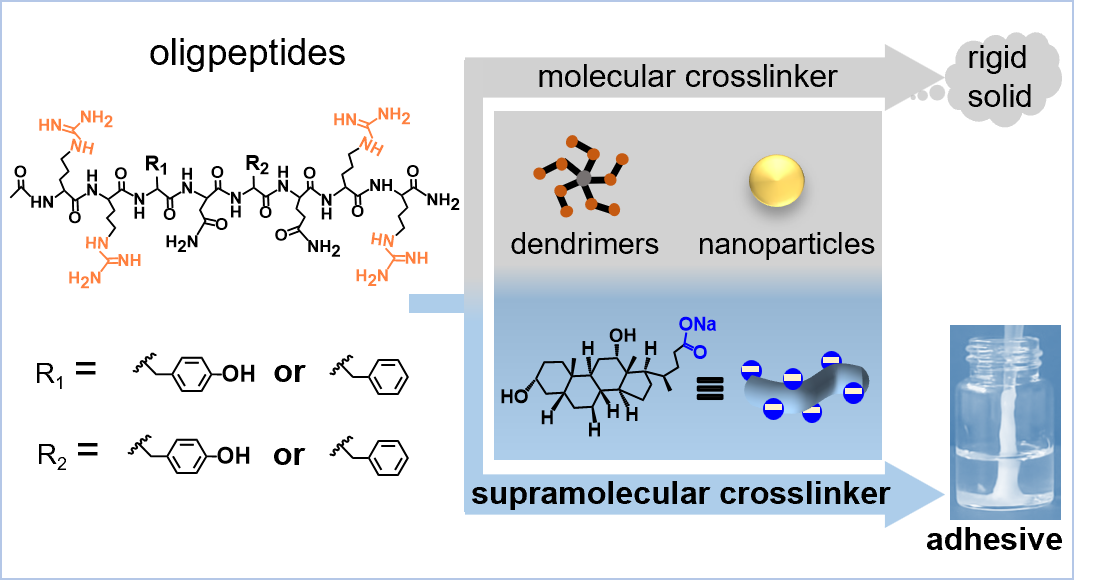
胶体型超分子交联剂构建寡肽仿生水下胶黏剂的示意图
论文链接:
//pubs.acs.org/doi/10.1021/acs.nanolett.5c02173